肿瘤免疫中的NK细胞
文章发布于:2021-07-23 21:59:58
人类自然杀伤细胞 (NK) 占所有循环淋巴细胞的15%。NK细胞发现于20世纪70年代,主要与杀死感染的微生物和恶性转化的同种异体和自体细胞有关。NK细胞表现出抗肿瘤细胞毒性,无需事先致敏和产生细胞因子以及调节各种免疫反应的趋化因子。以NK细胞为基础的肿瘤免疫治疗领域已经到了一个激动人心的关头。虽然这些疗法还没有取得与过继性T细胞疗法同样程度的临床成功,但是早期的令人鼓舞的结果使NK细胞疗法在开发其潜力方面的热情越来越高。下面我们来一起回顾一下肿瘤免疫治疗中的NK细胞。
NK细胞是第一个被鉴定的先天性淋巴细胞(ILC)亚型,能对病毒感染和/或转化的细胞产生多种效应器功能,主要是细胞杀伤和产生促炎细胞因子。NK细胞和其他ILC家族成员(—1型ILC(ILC1s)、ILC2s和ILC3s)与B细胞和T细胞来源于相同的淋巴祖细胞。NK细胞的细胞毒性活性使它们在功能上与CD8+T细胞最为相似,而ILC1、ILC2和ILC3群体的细胞因子生成模式将这些细胞分别对应CD4+T细胞的TH1、TH2和TH17亚群。
NK细胞的两个最典型的亚群是CD56brightCD16-和CD56dimCD16+群体。CD56bright细胞在外周血中的数量较少(循环中90%的NK细胞是CD56dim),而组织中的NK细胞主要是CD56bright。CD56bright NK细胞是强有力的细胞因子产生者,除非受到促炎性细胞因子如IL-15的刺激,否则细胞毒性较弱。相比之下,CD56dim NK细胞群可介导感染细胞和恶性细胞的连续杀伤,主要通过包含颗粒酶B和穿孔素的预先组装的溶细胞颗粒在免疫突触中的胞吐,最终诱导靶细胞凋亡。
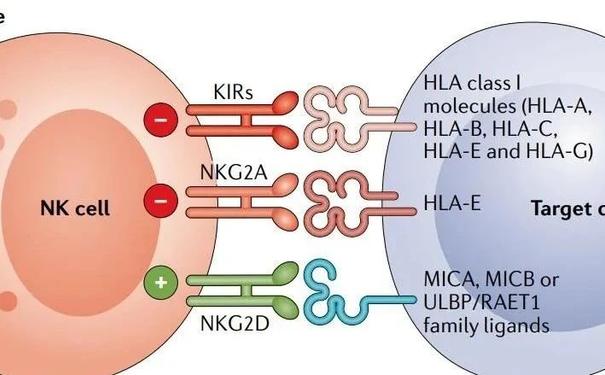
与B细胞和T细胞不同,NK细胞不表达体细胞重排的抗原受体,而是激活受体和抑制受体的随机组合。通过这些不同受体的刺激信号与抑制信号的平衡产生对靶细胞的反应或耐受。MHC-I(主要组织相容性复合物Ⅰ类)抗原特异性的抑制性受体可密切调节NK细胞介导的细胞毒性和淋巴因子的产生。MHC-I特异性受体的抑制信号对于造血细胞避免NK细胞的破坏至关重要。这个概念被称为“丢失自我”,最初是由 Ljunggren和Karre 提出的。这种MHC-I识别抑制性受体形成了NK细胞表面受体的三个家族,即KIRs(杀伤细胞免疫球蛋白样受体)、LIRs(白细胞免疫球蛋白样受体)和NKG2A(自然杀伤细胞2族A)。
KIRs是免疫球蛋白超家族的成员,是识别经典人类白细胞抗原A、B和C(HLA-Ia类)的I型跨膜分子。LIRs又称ILTs(免疫球蛋白样转录物),形成第二组受体,除了HLA Ia类外,主要识别非经典HLA-G(Ib类)分子。LIRs与KIRs属于同一个Ig超家族。NKG2A是NKG2族的一个成员,包括A、B、C、D、E、F和H,与CD94二聚形成NKG2A/CD94受体。它属于受体的C型凝集素家族,识别非经典HLA-EⅠ类分子作为其配体。
NK细胞的杀伤作用不仅需要通过抑制性受体检测转化细胞上的MHC-I分子,还需要通过激活性受体激活NK细胞。自然细胞毒性受体(NCR)是一组自然杀伤细胞表面激活性受体,包括NKp46、NKp30和NKp44。这些受体以及NKG2D和DNAM-1(DNAX辅助分子-1)识别病毒感染或恶性转化细胞表面表达的配体。一些共受体(2B4、NKp80、NTB-A和CD59)也被表达,它们只有与其他激活性受体结合才能发挥作用。CD16(或FcγRIII)也是一种激活性受体,主要由CD56dim NK细胞亚群表达,对IgG包被靶细胞的抗体依赖性细胞毒性(ADCC)至关重要。
NK细胞具有多种功能,可以限制癌细胞的生长和扩散。在TME先天性和适应性免疫细胞产生促炎性趋化因子的指导下,循环NK细胞可被招募到肿瘤发生的部位。CXCR3–CXCR4、CX3CR1和CCR3–CCR5是NK细胞亚群差异表达的主要趋化受体,这些细胞亚群对癌症免疫反应产生的趋化因子梯度作出反应。
进入TME后,NK细胞可以通过“丢失自我”机制杀死癌细胞。如前所述,NK细胞的活化是通过抑制受体与I类HLA(MHC I)分子结合而抑制的。然而,许多癌细胞下调MHC I分子的表达,以逃避细胞毒性CD8+T细胞的检测;因此,由于缺乏通过抑制受体的MHC I诱导的信号传导,以及随后激活信号的增加,NK细胞能够识别和响应这种缺失的自我表型的细胞,最终导致靶细胞裂解。因此,在T细胞不能识别MHC I下调导致的癌细胞的情况下,NK细胞具有治疗潜力。
ADCC是NK细胞介导的杀伤癌细胞的另一个关键机制,这种活性可以通过针对肿瘤相关抗原的治疗性单克隆抗体来加以利用。除了直接诱导细胞毒性外,NK细胞还通过产生促炎性细胞因子(包括IFNγ和TNF)对转化细胞作出反应。这些多效性蛋白质除了能够增强细胞毒性CD8+T细胞反应外,对癌细胞具有强大的抗增殖、抗血管生成和促凋亡作用。
尽管NK细胞在控制肿瘤生长方面具有活性,但它们对多种免疫抑制机制敏感,这些机制在TME中是活跃的。许多与癌症相关的可溶性免疫抑制分子对NK细胞功能产生负面影响,包括IL-10、吲哚胺2,3-双加氧酶、前列腺素E2和巨噬细胞移动抑制因子。转化生长因子β(TGF-β)是目前研究最多的对NK细胞具有免疫抑制作用的分子之一。TGFβ可由TME中的多种免疫细胞亚群产生,包括调节性T(Treg)细胞、髓源性抑制细胞(MDSCs)和肿瘤相关巨噬细胞(TAM),以及自身的癌细胞。已知这种多效性细胞因子可下调NK细胞功能的多个方面,包括细胞因子分泌、脱颗粒、代谢和mTOR信号。因此,拮抗转化生长因子β是提高免疫治疗效果的一种潜在策略。事实上,同时针对转化生长因子β和免疫检查点蛋白的双功能“陷阱”正在几个临床试验中进行测试(例如,NCT03631706)。
缺氧是TME中NK细胞杀伤活性的另一个重要障碍。大的实体瘤没有很好的血管化,因此,通常包含大量低氧浓度的区域,其中NK细胞的活性基本上(但不是完全地)消失。这种情况导致激活受体和死亡受体下调,颗粒酶B通过自噬降解,NK细胞分泌的细胞因子减少。旨在克服TME中缺氧的各种治疗方法,包括缺氧诱导的前药和HIF-1靶向治疗,正在临床开发中(例如,NCT01746979)。除此之外,抑制NK细胞活性的影响因素还包括NK细胞激活受体的可溶性配体、IL-37和CIS.
因此,越来越多的研究表明有效的方法可以克服肿瘤对NK细胞的各种防御作用以及TME对这些细胞的抑制作用。这些策略有可能提高NK细胞治疗方法的有效性。
关于ICI的研究主要集中在抗肿瘤T细胞的去抑制,这种治疗模式增强NK细胞的活性也引起了相当大的关注。例如,人源化抗NKG2A单克隆抗体monalizumab目前正在对多种癌症患者进行单药试验,或与其他免疫检查点抑制剂联合应用,临床前数据表明这种药物能显著增强NK细胞和T细胞的细胞毒性。
KIR拮抗剂的临床试验结果喜忧参半,KIR2D特异性单克隆抗体IPH2101(靶向KIR2DL1、KIR2DL2和KIR2DL3)因缺乏疗效而暂停II期临床试验(NCT01248455)。另外一项针对AML患者的IPH2101的I期试验显示,尽管药物耐受性良好,但没有任何疗效。尽管有这些令人沮丧的结果,KIR抑制剂的临床试验并不是绝对的阴性。事实上,lirilumab和nivolumab联合应用对29例晚期头颈部鳞状细胞癌(NCT01714739)患者产生了良好的临床活性(ORR 24%)。这些观察结果增加了对其他一些正在进行的抗KIR单克隆抗体临床试验的信心。
具有Ig和ITIM结构域的T细胞免疫受体(TIGIT)是另一种由NK细胞和T细胞表达的抑制性受体,其配体在人类肿瘤浸润的NK细胞上过表达。在一些小鼠模型中,TIGIT抑制逆转NK细胞衰竭并促进NK细胞依赖性抗肿瘤免疫。已经设计了一些积极的临床试验来测试单独抗TIGIT药物以及与其他免疫检查点抑制剂联合使用的有效性和/或安全性。(如NCT03119428、NCT04150965、NCT04047862、NCT04256421、NCT03563716和NCT04294810)
T细胞免疫球蛋白粘蛋白受体3(TIM-3)是另一种具有抑制特性的免疫检查点蛋白,由各种白细胞(包括NK细胞)表达,并与已知在人类肿瘤上表达的配体galectin-9结合。肺腺癌患者NK细胞上TIM-3表达增加预示着不良预后,体外抑制这种NK细胞的TIM-3增强了其细胞毒性和IFNγ的产生。目前,一些临床试验正在对各种癌症患者进行TIM-3抑制剂的试验,(NCT0331142、NCT03066648、NCT03489343、NCT03680508、NCT03961971、NCT04370704、NCT02817633、NCT03099109、NCT03744468和NCT04139902)。
在淋巴细胞中广泛表达抑制性蛋白,包括淋巴细胞活化基因-3(LAG-3)。来自小鼠NK细胞研究的数据表明LAG-3在介导对肿瘤细胞系的细胞毒性方面起着积极作用。受LAG-3抑制抗肿瘤T细胞的临床前效应的鼓舞,一些临床试验正在测试这种方法对各种恶性肿瘤患者的疗效(包括NCT01968109、NCT04150965、NCT04140500和NCT03625323)。其它基于NK细胞的免疫检查点还包括CD96、 Siglec-7/9、CD200R、CD47、CTLA-4、PD-1和B7-H3,将这些检查点结合起来进行协同抗肿瘤反应是未来充分发挥NK细胞杀伤肿瘤作用的方向。
各种免疫逃避机制限制了NK细胞在体内与肿瘤细胞的结合程度,是实现广泛有效的NK细胞治疗的主要障碍。为了增强肿瘤浸润性NK细胞的自然细胞毒性,许多研究团队已经在开发一些分子,使这些细胞以抗原特异性的方式与肿瘤细胞接触。这些分子通常是由多个抗体(通常为单链抗体)组成的双特异或三特异性接合器,使得一个结构域针对NK细胞激活受体,另一个与特定肿瘤相关抗原结合。例如,一种由两个单链抗体组成的三特异性杀伤接合器(TriKE),一个针对NK细胞上的CD16,另一个针对AML细胞的CD33,通过IL-15结构域连接,该结构域旨在增强NK细胞的存活和增殖。
这种抗CD16、IL-15和抗CD33 TriKE(GTB-3550)增强了NK细胞效应器功能的其他几个重要方面,在临床前研究中观察到了改善迁移能力、增加连续杀伤和缩短首次杀伤时间。在人类骨髓增生异常综合征的小鼠异种移植模型中证实了强有力的抗肿瘤和促增殖作用,目前正在进行一项I期试验,该试验涉及复发和/或难治性AML或骨髓增生异常综合征患者。
在临床前研究中,其他几种NKCE分子也被证明具有强大的抗肿瘤作用。这种新型的三功能NKCE分子,包括靶向CD16、NKp46和肿瘤相关抗原CD19、CD20或EGFR的单克隆抗体片段。重定向优化细胞杀伤(ROCK)分子包括由两个diabodies(scFv二聚体)组成的四价双特异性接合器分子。ROCK分子AFM13靶向淋巴瘤相关抗原CD30和CD16a,后者是NK细胞表达的CD16的跨膜形式。AFM13目前正在多个I期和/或II期试验中进行试验,包括各种实体和血液恶性肿瘤(NCT02321592、NCT03192202、NCT01221571、NCT04101331、NCT02665650和NCT04074746)。
DF1001是属于三特异性NKCE (TriNKETs)的几种药物之一。这种HER2靶向的TriNKETs的安全性和有效性正在对各种晚期HER2+实体瘤患者进行研究,包括结合抗PD-1抗体pembrolizumab。其他几家公司也正在开发类似的产品,预计在不久的将来将进入临床试验。
自体NK细胞输注是过继性NK细胞治疗的第一个主要焦点,因为使用患者自身血液作为细胞源非常方便,对免疫抑制治疗要求低,并且移植物抗宿主病(GvHD)的风险较低。对这种方法的研究表明,注入的细胞能够在体内扩张,但不能对血液或实体瘤产生有效的反应,这可能部分是由于自体NK细胞和自身MHC I分子之间相互作用的抑制作用。此外,接受输液的患者在细胞收集和治疗之前进行了大量的预处理,这可能会对NK细胞的扩增和功能产生负面影响。这些发现促使许多研究小组从自体NK细胞疗法转向同种异体NK细胞疗法。
脐血NK细胞
异基因外周血NK细胞只是治疗性NK细胞众多潜在来源之一。NK细胞约占外周血淋巴细胞总数的10%,而脐带血(UCB)中的NK细胞占淋巴细胞总数的30%;因此,UCB是治疗效应NK细胞的可靠来源。UCBNK细胞的治疗效果目前正在一些临床试验中进行评估(如NCT01619761和NCT02280525)。UCB也是造血祖细胞(HPC)的丰富来源,因此可以作为具有理想表型的治疗性NK细胞体外分化的底物,包括适应性NK细胞,这是一个令人兴奋的免疫治疗研究和发展的新途径。
NK细胞系
克隆性NK细胞系,如NK-92、KHYG-1和YT细胞,是异基因NK细胞的替代来源,NK-92细胞系已在临床试验中得到广泛测试。然而,这些细胞是非整倍体,因此遗传不稳定,这就要求它们在输注前接受辐照。辐照的NK-92细胞被观察到可以杀死癌症患者的肿瘤细胞。该产品目前正在进行四项临床试验,涉及多种恶性肿瘤患者,并与抗PD-L1抗体avelumab加上肿瘤疫苗(NANT)或IL-15超抗原联合应用。
干细胞衍生的NK细胞
迄今为止,大多数采用的NK细胞疗法都涉及到外周血NK细胞、UCB NK细胞或NK-92细胞的使用,但上述每一种细胞源都有重要的缺点。事实上,由于与成本、血液收集延迟、献血者之间的变异性和献血中白细胞异质性有关的问题,人们强烈关注的焦点是从传统的同种异体细胞来源转向干细胞衍生的NK细胞,这些细胞可作为任何患者的标准化“现成”疗法。
目前,临床上正在对来自多种来源的干细胞衍生NK细胞产物进行检测,包括来自UCB干细胞或诱导多能干细胞(IPSC)的NK细胞产物。
将成年细胞重新编程为多能干细胞,以使其分化为NK细胞并扩展生成最终产物,是基于iPSC的方法的一个独特特征。该方法标准化了起始材料,并在NK细胞治疗的开发和管理中提供了更大的均匀性和重复性。一项临床试验目前正在招募血液或实体癌患者,以测试这些现成的iPSC衍生NK细胞的安全性。此外,一些转基因iPSC衍生NK细胞产品正在对各种癌症患者进行临床调查。这些产品包括表达高亲和力CD16变体的iPSC衍生NK细胞,该变异体也能抵抗ADM17的蛋白质水解裂解。
CAR-NK细胞
随着CAR-T细胞治疗取得的临床成功,大量的努力被应用于探索CAR-NK细胞产品的疗效以及它们比同类T细胞的潜在优势。
一种CAR-NK细胞产品,该细胞表达编码抗CD19 CAR、IL-15的基因和可诱导的caspase-9自杀开关,该自杀开关通过小分子二聚化剂使体内的基因工程细胞得以根除。来自该产品临床前研究的数据表明,在体外有效地杀死表达CD19的原发性白血病细胞,由于IL-15的表达,NK细胞存活时间显著延长,并且在触发自杀开关后迅速消除。在CD19+B细胞淋巴瘤或CLL患者中,这种CAR-NK细胞产物的CR率为64%(7/11),无任何重大不良反应(无CRS、神经毒性或GvHD)。
目前对CAR-NK细胞的临床试验主要集中在来自干细胞或祖细胞来源的产品。CAR NK-92细胞的大量临床试验正在进行中,但是对辐照的要求和随后的持久性问题是这些产品临床疗效的潜在限制。一系列来自不同来源的CAR NK细胞的I期试验,包括自体外周血NK细胞、UCB NK细胞、NK-92细胞和IPSC,其目的是针对多种癌症,如AML、所有或其他B细胞恶性肿瘤、非小细胞肺癌(NSCLC)、卵巢癌或胶质母细胞瘤,当前处于活动状态。
适应性NK细胞
适应性NK细胞是治疗性NK细胞的另一个新兴来源。适应性NK细胞是一种自然发生的细胞群,在HCMV感染或再激活后在人类中扩增。HCMV UL40衍生肽抗原-HLA-E复合物与NK细胞上NKG2C之间的相互作用,导致NKG2ChiCD57+NK细胞增殖,NKG2ChiCD57+NK细胞下调参与细胞内信号传导的某些蛋白质,包括PLZF、SYK和FcεRIγ。适应性NK细胞具有一些独特的效应器特性,包括增强的ADCC、增强的细胞因子反应和对MDSCs和Treg细胞免疫抑制作用的固有抵抗。目前,三项临床试验正在评估这些适应性NK细胞对各种癌症患者的疗效。
CIML NK细胞
细胞因子诱导记忆样(CIML)NK细胞是异基因细胞治疗的另一种选择,与其他类型的NK细胞产品相比具有独特的优势。CIML-NK细胞在体外通过IL-12、IL-15和IL-18的短暂启动,产生对细胞因子反应增强的NK细胞,并激活持续数周至数月的受体刺激。将这些CIML-NK细胞输注到携带AML异种移植物的小鼠体内可产生强大的抗肿瘤作用并显著延长存活时间。在I期试验中,CIML NK细胞具有良好的安全性,在44%的可评估AML患者(4/9)体内扩增并诱导病情缓解。
自然杀伤细胞是一组独特的抗肿瘤效应细胞,具有不受MHC限制的细胞毒性、产生细胞因子和免疫记忆等功能,使其成为先天性和适应性免疫反应系统中的关键角色。一些癌症的发生与功能失调的NK细胞有关。因此,修复这种NK细胞可能是抗肿瘤免疫治疗的一个潜在选择。这种修复的一种方法是抑制免疫检查点,即癌细胞通过控制免疫细胞表面的抑制受体进行免疫逃逸。
此外,NK细胞疗法是一个很有前途的临床研究领域,对某些癌症患者具有良好的安全性和初步疗效。特别是,几个小组已经独立地证实了过继异基因NK细胞在AML患者中具有强大的抗肿瘤活性。
最后,利用NK细胞与抗体、免疫细胞接合器、CARs和其它检查点抑制剂的组合方法进行试验,这些方法旨在调节抑制检查点和增强抗肿瘤能力。目标是找到一种基于NK细胞的治疗策略,这种策略是安全的,并且具有广泛临床应用所需的确切疗效。